| 化學是探討物質的性質及其變化的科學,也是實驗的科學。有些從事化學教育的學者專家認為學生在中等學校的階段,透過實驗來學習化學最有效,而認知還在具體操作期的小學生,更需要實驗來幫助了解化學原理。化學變化的分類方式有多種,一般將其分為四種:(一)化合、(二)分解、(三)置換、(四)複分解;但也可依氧化數的變化以及生成物產生沉澱與否,而將化學反應分為凡人類:(一)氧化還原反應;(二)酸鹼反應;(三)沉澱反應。本篇以「趣味化學實驗與科學思考」為標題,對上述的四種反應各舉簡而有趣的化學( Plain and Attractive Chemistry,簡稱 PAC)實驗提供教師作為演示實驗或學生實驗。這四種反應中,化合、分解與置換都屬於氧化還原反應,而複分解則多屬於酸鹼反應,但也有沉澱反應與氧化還原反應者。 |
| 一、化合與分解 |
(一)目的
- 1.利用兩種元素,鋅與碘,直接反應,化合成碘化鋅。
- 2.電解由化合所得的碘化鋅溶液,取回碘與鋅。
- 3.透過實驗讓學生能親眼目睹化學反應,亦即I2和Zn。的反應與其逆反應。
- 4.體會化合與分解的定義,被學習推測可能的生成物以及如何書寫化學反應式。
|
(二)器材

|
(三)實驗步驟
(甲)鋅與碘的化合
1.取 5 克的鋅粉與 5 克的碘粒,置於研缽研磨數分鐘(此操作,不會有任何明顯反應〉。得混合粉末。
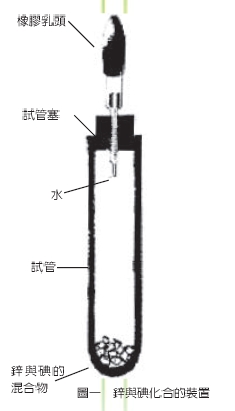
2.次將混合粉末移入大試管,輕蓋一個配有吸管的木塞(吸管內吸有水約 2 毫升),如圖一所示。
3.從滴管滴下水數滴,即見混合物冒出紅紫色氣體,試管底部發熱而有黃褐色液體。此時,再慢慢加水,一邊搖動試管讓昇華後凝華而附著在試管壁的碘繼續反應。加完水數分鐘後,可能還可以見到試管上端有紫黑色固體附著於管壁。
4.取下試管塞,用另一根長吸管吸取溶液,洗下管壁上的顆粒,即見顆粒溶解。黃褐色溶液沿管壁流下,使碘再與鋅粉作用。靜置數分鐘,見試管底部何未反應的金屬粉末沙與無色透明的溶液。
|
|
|
(乙)碘化鋅的分解
5.用吸管吸取試管內的混合物過濾,得無色透明濾液(過濾方法參考附錄中「簡易加壓過濾法」
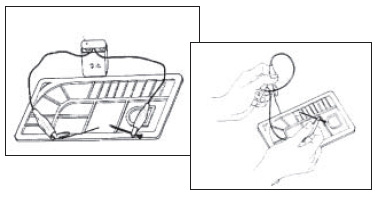
6.取上述無色透明的濾液數滴於水彩畫用的調色盤上,然後用迥紋針為陽極,銅線(或黃銅釘)為陰極,電解濾液數秒鐘,如圖二所示。即見鋼線上端為亮亮的銀灰色沉澱物所覆蓋,而迥紋針上有褐色固體析出,但會脫落溶解成黃褐色溶液。若在黃褐色溶液上滴下澱粉液,立即呈現藍色。
|
 |
|
(四)問題
1.在實驗步驟 3,「從滴管滴下水數滴,即見混合物冒出紅紫色氣體」。試問「水」在此反應中,扮演何種角色?
2.在實驗步驟 6 ,電解碘化鋅溶液時,為什麼陰極用銅線(或黃鋼釘)而不用迴紋針?
|
(五)教師手冊
本實驗包含兩部分:(一)化合與(二)分解。兩部分的實驗因相關,宜連續做,但也可分開單獨做。若分開單獨做時,第二部分的 「(乙)碘化鋅的分解」,教師最好在很短的時問內演示第一部分的「(甲)鋅與碘的化合」,然後直接給學生已過濾好的碘化鉀澄清溶液約1mL ,學生則做步驟6,在調色盤操作電解。
( A )教師演示實驗
1.取約 10 克的鋅粉與約 10 克的碘粒,置於研缽研廢數分鐘,不見有任何反應。(給學生看)
2.先準備一個無色透明的塑膠袋(約 25cm × 35cm ),並將其充滿空氣,袋口向下倒置於桌上後,用吸管吸取清水約2mL,滴入研缽即見冒出紫色氣體,相當壯觀,但因碘蒸氣有毒,應立即以塑膠袋蓋住,以免碘蒸氣擴散。
3.俟研缽不再冒碘蒸氣後,移去塑膠袋。在研缽壁上未反應的碘粒,用滴竹吸一些溶液將其沖入溶液中,即見碘又反應,但不再冒濃煙。
4.依前述學生實驗的步驟 5 的方式過濾碘化鉀溶液。
(B)補充說明
1.步驟 1 表示鋅與碘即使混合磨成粉末,也不起化學反應,但一加水,即見其放熱反應,留出紅紫色碘蒸氣。水在此反應中,扮演了重要的催化角色,可用下列反應式表示:
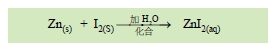
這是很典型的化合反應,由二種元素變成一種化合物。若將混合後的粉末移置於蒸發皿上,然後加水,即刻冒出紅紫色煙,著實相當狀觀。( 但為了避免吸入碘蒸氣.還是用步驟 2 與 3 的方法比較妥當)
2.步驟 6 是電解,也是很典型的分解反應之一,由一種化合物分解成兩種物質 ,可以用反應式表示如下:

3.電解時,陰極起還原反應,產生鋅。因金屬鋅的顏色與迥紋針的顏色相近,不易分辨,但鋅沉澱在銅線或銅釘上,則容易觀察到。
(C)廢棄物的處理
1.碘化鋅溶液沖稀後可以放流(因鋅過量,不會有未反應的碘留下來,而且量很少)。
2.鋅應回收。收集全班的鋅粉,用清水洗滌數次後,置於錶玻璃或研缽曬乾,絕不可置於舉塑膠製器皿或可燃的物體上晾乾(即將乾的鋅粉,有自行起火燃燒塑膠的可能性)。
|
(六)附錄:簡易加壓過濾法
在實驗室雖然有很多過濾的方法,但若試樣的量非常少,例如只有1毫升,則一般的過濾方法均因太少而不適用。這時可採用滴管過濾,方法如下 :
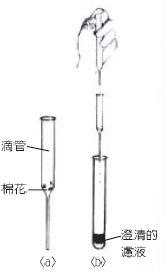
1.取下玻璃滴管的橡膠乳頭。
2.取脫脂棉花一小塊.溼潤後以玻璃捧將其壓進玻璃滴管內,如圖(a)所示(鬆緊視需要調整),即得一支過濾滴管。
3.以另一支滴管吸取需要過濾的混合物溶液後,將其滴入於過濾用的滴管內。
4.若混合物不易過濾,在過濾用滴管 上套回橡膠乳頭後,輕壓橡膠,即見混合物滴管被加壓而濾過棉花,而得澄清的濾液。
|
 |
|
| 二、置換反應 |
(甲)銅幣變銀幣
(一)目的
以簡單的實驗讓學生了解金屬活性的不同所引起的置換反應,被藉由鋼幣變銀幣的趣味實驗 ,以提高學生學習化學的興趣。
(二)器材
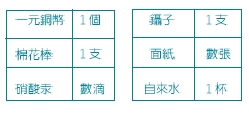
註:硝酸汞耍使用飽和溶液,並裝於點眼滴瓶。
(三)實驗步驟
1.取一元銅幣一個(新舊銅幣均可),用鑷子夾住後在銅幣上面滴下一滴硝酸汞飽和溶液,然後用棉花棒擦塗銅幣的一半(同一面的一半留供比較),即見擦塗過的銅幣表面呈現銀色。
2.將上一步驟的一元銅幣放入杯中水洗後用面紙擦乾,則得光亮的銀色,與沒擦塗硝酸汞的一半相比較,有何不同?
3.仔細觀察棉棒塗擦前後有何不同?
注意;硝酸汞有毒(管制品),必須小心使用,最好戴上外科醫生用的手套,用後要洗乾淨兩手。用過的棉花棒要聽從教師指示,回收集中處理。
|
(乙)鐵釘變銅釘
(一)目的
利用日常生活中容易取得的鐵釘與食醋,讓學生了解置換反應。
(二)器材
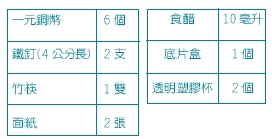
(三)實驗步驟
1.用透明塑膠杯取食醋約10毫升,放進 6 個舊硬幣(一元的銅幣),偶而用竹筷子翻動銅幣,仔細觀察銅幣表面有何變化。
2.約五分鐘後,用竹筷子取出銅幣(變亮了)三個,二正一反直接放在面紙上,其他三個用水清洗後,用面紙擦乾,也是二正一反放在面紙上,供作比較。
3.將浸泡過銅幣的食醋倒入底片盒中,放入兩之鐵釘或迴紋針(表面沒沾油,而且沒生鏽的,長度要夠長,要有一部份露出液面以便對照),不久即見有氣泡附在鐵釘上。
4.數十分鐘後,即見浸泡在溶液中的鐵釘表面,為一層紅銅色所覆蓋。
5.取出鐵釘後用水清洗乾淨。放置一段時間後,再看看銅色是否改變。
6.比較步驟 2 ,面紙上的銅幣,沒用水清洗的銅幣與清洗過的銅幣上有何不同?綠色的表面是什麼?
注意:廢液要聽從教師指示,集中後處理。
(四)問題
1.試問在(甲)實驗的步驟 3,塗擦銅幣後的棉花捧上是否還殘留有硝酸汞?要如何檢驗?
2.試問在(乙)實驗的步驟 2,銅幣為何變亮了?若改用硝酸以替代食醋來洗銅幣,試推測結果會怎樣?
(五〉教師手冊
(甲)鋼幣變銀幣
1.金屬活性次序在貴金屬的部份是銅、汞、銀、鉑、金.因此銅可以取代汞,用反應式表示如下:
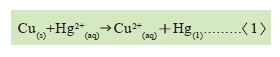
由上式可見汞離子,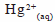 ,被取代而析出金屬(Hg)。汞在常溫是液態,但因其容易與其他金屬構成合金成汞齊(銅汞齊是固態),可用反應式表示: ,被取代而析出金屬(Hg)。汞在常溫是液態,但因其容易與其他金屬構成合金成汞齊(銅汞齊是固態),可用反應式表示:
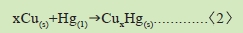
2.在棉花棒上:可以看出式(1)所析出的藍色銅離子,但若用來塗擦的銅幣表面不很乾淨 。
3.汞的化合物有毒,實驗後必須要求學生洗乾淨兩手,而且廢棄物要聽從教師指示處理。
4.汞化合物的廢棄物(溶液)收集後,加碘化鉀溶液或硫化鈉溶液使其成為碘化汞或硫化汞沉澱、過濾後沉澱貯存,交業者處理。
5.要檢驗棉花棒上是否有硝酸汞殘留,最好以碘化鉀溶液檢驗,因碘化汞的沉澱呈朱紅色易見,而且其Ksp很小。
(乙)鐵釘變銅釘
1.以上實驗說明了食醋洗淨了銅幣上的氧化銅或其他銅的化合物,但不傷及金屬銅本身,反應式如下:
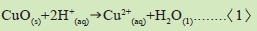
2.步驟3與4,說明了留在食醋中的銅離子,被鐵釘的鐵所置換,反應式如下:
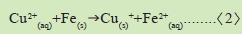
3.一般的銅綠是鹼式碳酸銅,但是銅幣表面上的成份相當複雜。
4.若沒有鐵釘,可用迴紋針(沒有塑膠皮包的)替代。
5.若用硝酸替代食醋以洗銅幣,結果會因稀硝酸仍具有氧化性,不僅與銅幣表面的銅化合物反應,而且會與銅幣本身(亦即銅)反應,產生有毒的氧化氮,反應式如下:
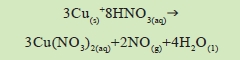
|
| 三、複分解(酸鹼中和反應) |
固體食鹽的直接製法
(一)目的
使用濃鹽酸與氫氣化鈉顆粒直接作用,以演示酸鹼中和產生固體的「鹽」,以肉眼即可看到的食鹽顆粒,並演示簡易減壓抽濾法。
(二)器材
注意:本實驗使用濃酸濃鹼,需要特別注意安全,沒有教師的允許與監督,學生不可動手操作,尤其下列實驗步驟2。

(三)實驗步驟
1.用硬試管取氫氧化鈉顆粒 2~4 克(約 6~10 粒,不可太多)。
2.用滴管吸取濃鹽酸後,一滴一滴慢慢地滴入試管。每滴一滴濃鹽酸即有相當劇烈的反應,產生大量的熱,甚至發煙並發出嘶嘶聲。
3.用玻璃棒攪拌,即見有白色的小顆粒沉澱,若鹽酸與氫氣化鈉的作用太劇烈,則用冷水浴冷卻試管,作用完畢還要多加濃鹽酸,再攪拌確保沒有氫氧化鈉殘留。
4.用簡易減壓過濾裝置(如圖四,取自蕭次融,科學教育月刊, 208 期 40 頁, 87 年 3 月)過濾,抽乾後用清水數滴清洗固體數次,至濾液呈現中性為止,即得 NaCl晶體。
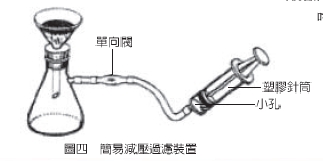
(四)問題
1.實驗步驟 2 ,為何產生大量的熱?
2.簡易減壓過濾裝置中的注射筒為何可打一個小孔,有何作用?若注射筒上不打孔,要如何才能達到減壓過濾的目的?
(五)教師手冊
1.教師在複分解的單元,教學時最常引用的例子是稀鹽酸與硝酸銀的作用,或鹽酸與氫氣化鈉的中和反應。後者也是酸鹼中和產生鹽的一個例子,雖然可以用反應式表示:
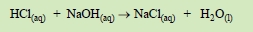
並說中和後的水溶液蒸乾即得固形的食鹽,但是蒸乾費時而艮所得固形食鹽的量很少,且外觀不像通常我們所見到的食鹽。本實驗則直接用濃鹽酸與固體的氫氣化鈉反應以得固體的食鹽。此反應產生大量的中和熱,因反應中的「水份」很少,使得反應混合物升高溫度甚多。此反應可用反應式表示:

式中(conc)表示濃的溶液,亦即使用濃鹽酸之意。演示本實驗時,教師必須帶護目鏡與塑膠手套,以策安全。
2.做科展或從事特別研究的高中生,得允許其親自操作實驗,但必需交代清楚有關強酸強鹼與其反應、應特別注意的事項,並接受教師的指導,尤其操作步驟 2 與步驟 3 時,濃鹽酸必須一滴一滴地慢慢加,抓時時攪拌。
3.所製作的食鹽成品必須檢驗其酸鹼值、確保中性,否則不可試嚐。
4.若注射筒上沒有打一小孔,則注射筒的活塞抽了後就難於壓回原狀。若筒上沒打孔,在軟管間要裝一個三向閥才可以完成減壓過濾。
|